تکنیک واکنش زنجیرهای پلیمراز (PCR) یکی از ابزارهای کلیدی در زیستفناوری و پزشکی مولکولی است که از زمان ابداع آن توسط کری مولیس در دهه ۱۹۸۰، تحول عظیمی در تشخیص مولکولی بیماریها بهویژه بیماریهای ویروسی ایجاد کرده است. این تکنیک به دلیل حساسیت بالا، ویژگی قوی و توانایی تشخیص سریع، به یکی از روشهای استاندارد در شناسایی ویروسها تبدیل شده است. در این مقاله، به بررسی اصول عملکرد PCR، انواع مختلف آن، کاربردهایش در تشخیص ویروسها، چالشها و پیشرفتهای اخیر در این زمینه پرداخته میشود.
اصول عملکرد PCR
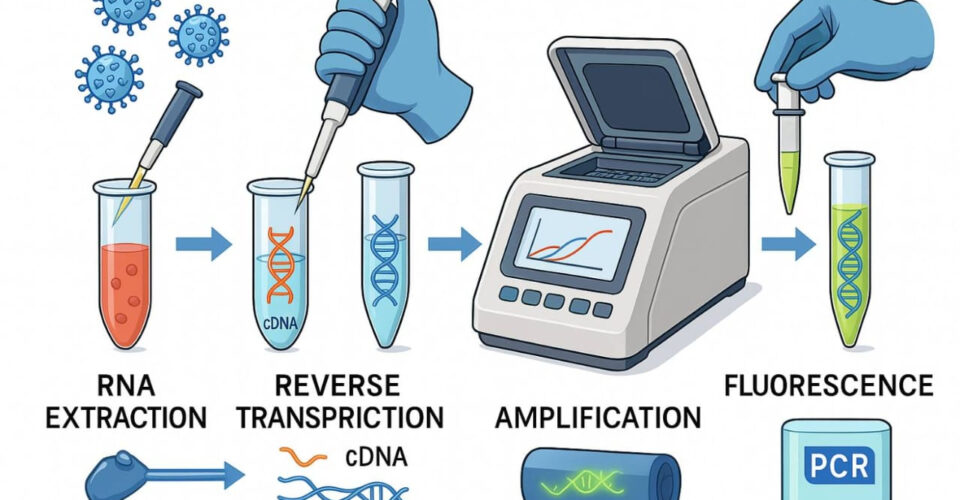
PCR یک روش آزمایشگاهی است که برای تکثیر بخش خاصی از DNA یا RNA (در صورت استفاده از نسخه معکوس) به کار میرود. این فرآیند شامل سه مرحله اصلی است:
دناتوراسیون (Denaturation): در دمای بالا (حدود ۹۵ درجه سانتیگراد)، DNA دو رشتهای به تکرشتهای تبدیل میشود.
اتصال پرایمر (Annealing): در دمای پایینتر (۵۰-۶۰ درجه سانتیگراد)، پرایمرهای اختصاصی به توالی هدف متصل میشوند.
گسترش (Extension): در دمای حدود ۷۲ درجه سانتیگراد، آنزیم Taq پلیمراز، نوکلئوتیدها را به رشته در حال ساخت اضافه میکند.
این چرخهها چندین بار تکرار میشوند تا مقدار DNA هدف بهطور تصاعدی افزایش یابد. در تشخیص ویروسها، معمولاً از RT-PCR (Reverse Transcription PCR) استفاده میشود که ابتدا RNA ویروسی به cDNA تبدیل شده و سپس تکثیر میشود.
انواع PCR در تشخیص ویروسها
PCR کلاسیک: این روش برای شناسایی حضور یا عدم حضور ویروس در نمونه استفاده میشود. پس از تکثیر، محصولات PCR با استفاده از الکتروفورز ژل بررسی میشوند.
RT-PCR (Real-Time PCR): این روش امکان مشاهده تکثیر DNA را در زمان واقعی فراهم میکند و با استفاده از پروبهای فلورسنت یا رنگهای اتصالدهنده به DNA (مانند SYBR Green) انجام میشود. این روش به دلیل سرعت و دقت بالا در تشخیص ویروسهایی مانند SARS-CoV-2 بسیار پرکاربرد است.
Multiplex PCR: این تکنیک امکان شناسایی همزمان چندین ویروس را در یک نمونه فراهم میکند، که در تشخیص بیماریهای تنفسی ویروسی مانند آنفلوانزا و ویروس سینسیشیال تنفسی (RSV) مفید است.
Digital PCR (dPCR): این روش با تقسیم نمونه به هزاران واکنش کوچک، امکان اندازهگیری دقیق مقدار اسید نوکلئیک را فراهم میکند و در مواردی که نیاز به حساسیت بسیار بالا است (مانند تشخیص ویروسهای با بار ویروسی کم) استفاده میشود.
کاربردهای PCR در تشخیص ویروسها
PCR به دلیل ویژگیهای منحصربهفرد خود، کاربردهای گستردهای در تشخیص مولکولی ویروسها دارد:
تشخیص سریع بیماریهای ویروسی: PCR امکان شناسایی ویروسهایی مانند HIV، هپاتیت C، SARS-CoV-2 و ویروس زیکا را در مراحل اولیه عفونت فراهم میکند.
تعیین بار ویروسی: با استفاده از RT-PCR، میتوان مقدار ویروس در نمونههای بالینی را اندازهگیری کرد، که در مدیریت درمان بیماران HIV یا هپاتیت بسیار مهم است.
شناسایی سویههای ویروسی: با استفاده از PCR و توالییابی، میتوان سویههای مختلف ویروس (مانند واریانتهای SARS-CoV-2) را شناسایی کرد.
تشخیص در نمونههای پیچیده: PCR قادر به شناسایی ویروسها در نمونههای بیولوژیکی متنوع مانند خون، بزاق، سواب نازوفارنکس و حتی نمونههای محیطی است.
چالشها و محدودیتها
با وجود مزایای فراوان، PCR نیز با چالشهایی مواجه است:
آلودگی نمونهها: آلودگی با DNA خارجی میتواند به نتایج مثبت کاذب منجر شود.
نیاز به تجهیزات پیشرفته: دستگاههای PCR و RT-PCR هزینهبر هستند و نیاز به پرسنل آموزشدیده دارند.
حساسیت به مهارکنندهها: برخی مواد موجود در نمونههای بالینی (مانند هموگلوبین یا موکوس) میتوانند واکنش PCR را مختل کنند.
محدودیت در تشخیص ویروسهای جدید: طراحی پرایمرهای اختصاصی برای ویروسهای نوظهور زمانبر است.
پیشرفتهای اخیر
در سالهای اخیر، پیشرفتهای قابلتوجهی در فناوری PCR صورت گرفته است:
اتوماسیون و دستگاههای قابلحمل: دستگاههای PCR قابلحمل مانند Cepheid GeneXpert امکان انجام آزمایش در محل (Point-of-Care) را فراهم کردهاند.
توسعه پروبهای جدید: پروبهای فلورسنت با حساسیت و ویژگی بالاتر، دقت تشخیص را بهبود بخشیدهاند.
ترکیب با فناوریهای دیگر: استفاده از PCR در کنار توالییابی نسل بعدی (NGS) امکان شناسایی سریع و جامع ویروسهای ناشناخته را فراهم کرده است.
کاهش زمان واکنش: روشهای جدید مانند Fast PCR زمان تکثیر را به کمتر از ۲۰ دقیقه کاهش دادهاند.
نتیجهگیری
تکنیک PCR به دلیل دقت، سرعت و انعطافپذیری، به ابزاری ضروری در تشخیص مولکولی ویروسها تبدیل شده است. با پیشرفتهای اخیر در این فناوری، انتظار میرود که کاربردهای آن در آینده گسترش یابد و نقش مهمی در مدیریت بیماریهای عفونی ایفا کند. با این حال، برای استفاده بهینه از این فناوری، نیاز به بهبود زیرساختها، کاهش هزینهها و آموزش پرسنل وجود دارد.
منابع
Mullis, K. B. (1990). The unusual origin of the polymerase chain reaction. Scientific American, 262(4), 56-65.
Saiki, R. K., et al. (1988). Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase. Science, 239(4839), 487-491.
Bustin, S. A. (2000). Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays. Journal of Molecular Endocrinology, 25(2), 169-193
Espy, M. J., et al. (2006). Real-time PCR in clinical microbiology: Applications for routine laboratory testing. Clinical Microbiology Reviews, 19(1), 165-256.
Mackay, I. M., et al. (2002). Real-time PCR in virology. Nucleic Acids Research, 30(6), 1292-1305.